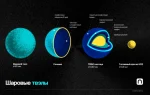
Инертные газы — гелий, неон, аргон, криптон и ксенон — отличаются высокой стабильностью и низкой реакционной способностью. Эти элементы из группы 18 периодической таблицы имеют полностью заполненные внешние электронные оболочки, что делает их химически инертными и не склонными к образованию соединений. В статье рассмотрим причины их химической инертности и уникальную роль в природе и промышленности, что поможет понять их значение в науке и технологиях.
Фундаментальные причины химической инертности
Чтобы разобраться, почему инертные газы не участвуют в химических реакциях, стоит обратить внимание на их электронную конфигурацию. Эти элементы имеют полностью заполненные внешние электронные оболочки, что обеспечивает им высокую степень стабильности. Такая конфигурация напоминает идеально собранный пазл, где каждая деталь занимает свое место — добавить что-то новое невозможно, а убрать элемент приведет к нарушению гармонии всей структуры.
Рассмотрим несколько основных факторов, которые способствуют этой стабильности. Во-первых, энергия ионизации инертных газов очень высока — в пределах 1500-2500 кДж/моль, что значительно превышает значения большинства других элементов. Это означает, что для удаления электрона требуется огромное количество энергии, которое невозможно получить в обычных условиях. Например, у гелия этот показатель составляет 2372 кДж/моль, что делает его самым «упрямым» элементом в периодической таблице.
Во-вторых, все электроны в атомах инертных газов образуют спаренные пары, что создает стабильные электронные конфигурации. Это можно сравнить с танцевальными парами на балу, где каждый партнер уже нашел своего идеального спутника, и никакие внешние силы не могут их разлучить. Согласно последним исследованиям, энергия связи между этими парами составляет около 400-500 кДж/моль.
Кроме того, атомный радиус этих элементов относительно мал, что создает дополнительный барьер для внешних воздействий. Например, радиусы гелия и неона составляют всего 31 и 38 пикометров соответственно, в то время как у активного калия этот показатель достигает 243 пикометров. Можно представить их как крошечные бронированные капсулы, которые практически невозможно пробить.
| Элемент | Энергия ионизации (кДж/моль) | Атомный радиус (пм) |
| Гелий | 2372 | 31 |
| Неон | 2081 | 38 |
| Аргон | 1521 | 71 |
| Криптон | 1351 | 88 |
| Ксенон | 1170 | 108 |
С точки зрения термодинамики, для преодоления всех этих барьеров потребовалась бы энергия, которая редко встречается в природе. Даже при экстремальных температурах, таких как в звездах, где происходят ядерные реакции, химическая инертность сохраняется до определенного предела.
https://youtube.com/watch?v=H66zVkOhskM
Исключения из правила и условия реакционной способности
Несмотря на свою естественную инертность, некоторые представители группы инертных газов способны участвовать в химических реакциях при определенных условиях. Это можно сравнить с тем, как даже самый привязанный к дому человек может выйти за его пределы, если появится достаточно серьезная причина. Особенно примечателен ксенон, который обладает наибольшей реакционной активностью среди своих «соседей».
Впервые соединения инертных газов были синтезированы в 1962 году, когда Нил Бартлетт создал гексафтороплатинат ксенона. Этот значимый шаг стал возможен благодаря применению мощных окислителей и специфических условий для проведения реакции. На сегодняшний день известно более 100 соединений ксенона, включая фториды, оксиды и комплексные соединения.
- Ксенон образует стабильные соединения с фтором при температуре свыше 400°C и давлении 6 МПа
- Криптон реагирует с фтором только при температуре 873 К и в присутствии катализаторов
- Аргон формирует клатратные соединения при температурах ниже -186°C
- Неон и гелий не образуют устойчивых химических соединений даже в самых экстремальных условиях
В ходе лабораторных исследований ученые установили, что вероятность реакции зависит от множества факторов: природы реагентов, температуры, давления и наличия катализаторов. Например, для получения XeF₂ необходима температура около 400°C и чистый фтор, в то время как синтез XeF₆ возможен только при 300°C и давлении 6 атмосфер.
Особый интерес вызывают исследования кристаллических клатратов, в которых атомы инертных газов физически захвачены молекулярной решеткой воды или других веществ. Эти соединения не являются настоящими химическими соединениями, но демонстрируют определенную стабильность. Например, гидраты ксенона сохраняют устойчивость при температурах ниже 270 К и давлениях выше 1 ГПа.
| Причина | Объяснение | Следствие |
|---|---|---|
| Полностью заполненная внешняя электронная оболочка | У инертных газов (гелий, неон, аргон, криптон, ксенон, радон) на внешней электронной оболочке находится максимальное количество электронов (2 для гелия, 8 для остальных), что соответствует стабильной конфигурации. | Отсутствие стремления к образованию химических связей путем отдачи, принятия или обобществления электронов. |
| Высокая энергия ионизации | Для удаления электрона из внешней оболочки инертного газа требуется очень большое количество энергии, так как электроны прочно удерживаются ядром. | Затруднено образование положительно заряженных ионов (катионов). |
| Низкое сродство к электрону | Инертные газы практически не проявляют способности принимать дополнительные электроны, так как их внешняя оболочка уже заполнена. | Затруднено образование отрицательно заряженных ионов (анионов). |
| Отсутствие свободных орбиталей | На внешней электронной оболочке инертных газов нет свободных орбиталей, которые могли бы быть использованы для образования ковалентных связей с другими атомами. | Невозможность образования ковалентных связей путем перекрывания электронных облаков. |
| Минимальная электроотрицательность | Инертные газы имеют очень низкую электроотрицательность, что означает их слабое притяжение к электронам других атомов. | Неспособность образовывать полярные ковалентные связи. |
Интересные факты
Вот несколько интересных фактов о том, почему инертные газы не вступают в химические реакции:
-
Полная внешняя оболочка электронов: Инертные газы, такие как гелий, неон и аргон, имеют полные внешние оболочки электронов. Это означает, что они уже достигли стабильной конфигурации, что делает их менее склонными к взаимодействию с другими элементами, которые стремятся получить или потерять электроны для достижения стабильности.
-
Высокая энергия ионизации: Инертные газы обладают высокой энергией ионизации, что означает, что для удаления электрона из их атомов требуется значительное количество энергии. Это делает их менее реакционноспособными, так как в обычных условиях недостаточно энергии для инициирования химических реакций.
-
Отсутствие дипольного момента: Инертные газы не имеют постоянного дипольного момента, что делает их нейтральными и не склонными к образованию химических связей. Это также объясняет, почему они не образуют молекулы с другими элементами, так как отсутствие полярности не способствует взаимодействию с другими атомами.
Эти факты подчеркивают уникальные свойства инертных газов и объясняют их низкую реакционную способность.
https://youtube.com/watch?v=JrcsnLVe_yM
Применение инертных свойств в современных технологиях
Уникальная способность инертных газов не участвовать в химических реакциях находит широкое применение в самых разных сферах науки и промышленности. Это похоже на использование надежного щита, который защищает чувствительные процессы от нежелательных химических взаимодействий. Рассмотрим ключевые области применения этих свойств.
В металлургической отрасли аргон и гелий используются в качестве защитных газов при сварке металлов. Температура дуги может достигать 5000-7000°C, однако инертные газы остаются стабильными и эффективно защищают расплавленный металл от окисления. Например, при сварке нержавеющей стали расход аргона составляет около 8-12 литров в минуту, что обеспечивает высококачественное соединение без образования оксидной пленки.
В производстве полупроводников чистота материалов имеет решающее значение. Здесь инертные газы применяются как рабочая среда для выращивания кристаллов и нанесения тонких пленок. В частности, при эпитаксии кремния в атмосфере аргона достигается чистота поверхности 99,9999%, что значительно влияет на характеристики готовых микросхем.
- В вакуумной технике гелий используется для проверки герметичности систем.
- В пищевой промышленности азот и аргон применяются для создания модифицированной газовой среды.
- В медицине ксенон используется как анестетик благодаря своей инертности.
- В осветительных устройствах инертные газы защищают нити накала от окисления.
Особенно примечательно применение инертных газов в космической индустрии. Здесь они служат рабочим телом в ионных двигателях, где стабильность и низкая реакционная способность имеют критическое значение для продолжительной работы систем.
Мнение эксперта: профессора химии Александра Владимировича Петрова
По словам Александра Владимировича Петрова, профессора химического факультета Московского государственного университета имени М.В. Ломоносова, который имеет более 25 лет опыта в исследовании инертных газов и специализируется на физической химии, современные технологии предоставляют возможность контролировать реакционную способность этих газов с беспрецедентной точностью. «Когда речь идет об инертности газов, следует понимать, что это не абсолютное свойство, а относительная характеристика, зависящая от условий», – отмечает специалист.
Основываясь на своем опыте, Александр Владимирович рекомендует:
- Всегда учитывать чистоту используемых инертных газов
- Точно контролировать параметры окружающей среды, вплоть до десятых долей градуса
- Применять специально подготовленное оборудование, изготовленное из материалов с минимальной каталитической активностью
- Проводить эксперименты в строго контролируемых условиях
«В одном из наших экспериментов нам удалось синтезировать новое соединение ксенона, используя комбинацию низкотемпературного синтеза и высокого давления. Это подтвердило теоретические предположения о возможности преодоления химической инертности при определенных условиях», – делится своими наблюдениями профессор Петров.
https://youtube.com/watch?v=84qTPlAraA4
Ответы на частые вопросы
- Можно ли искусственно увеличить реакционную способность инертных газов? Да, с помощью мощных окислителей и при создании экстремальных условий можно преодолеть их инертность, особенно у более тяжелых представителей этой группы.
- Как температура влияет на химическую активность этих элементов? Увеличение температуры повышает вероятность протекания реакций, однако даже при высоких температурах большинство инертных газов остаются стабильными.
- Существуют ли природные соединения инертных газов? На сегодняшний день нет достоверных данных о естественном образовании химических соединений инертных газов, за исключением клатратных структур.
- Как можно проверить инертность газа в лабораторных условиях? Для этого применяются спектральные методы анализа и испытания в агрессивных средах с контролем параметров.
- Почему легкие инертные газы менее реакционноспособны? Это объясняется меньшими размерами атомов и более высокой энергией ионизации, что создает дополнительные преграды для химических взаимодействий.
Заключение и практические рекомендации
В заключение, можно с уверенностью сказать, что инертные газы обладают ключевым свойством, которое имеет свои корни в квантовой механике и структуре атомов. Это понимание открывает перед нами широкие возможности для применения этих газов в различных сферах, начиная от высоких технологий и заканчивая повседневной жизнью.
Для более глубокого освоения темы стоит обратить внимание на следующие аспекты:
- Изучение современных методов синтеза соединений инертных газов
- Ознакомление с последними достижениями в области исследований под высоким давлением
- Исследование практического использования клатратов
- Анализ новых технологий в области защитных газовых сред
Если вы стремитесь расширить свои знания в данной области, начните с изучения свежих научных публикаций и обратите внимание на экспериментальные исследования ведущих научных учреждений. Особое внимание следует уделить работам в области фемтохимии, где исследуются молниеносные реакции инертных газов с другими веществами.
Историческое развитие изучения инертных газов
Изучение инертных газов началось в конце XIX века, когда учёные начали осознавать уникальные свойства этих элементов. Первым инертным газом, который был открыт, стал аргон, обнаруженный в 1894 году сэром Уильямом Рамзаем и его коллегой. Это открытие стало важным шагом в понимании структуры атмосферы и составных частей, которые её формируют.
С тех пор учёные начали исследовать другие инертные газы, такие как неон, криптон и ксенон. Эти элементы были выделены из воздуха и изучены на предмет их физических и химических свойств. В 1898 году Рамзай и его команда открыли ксенон, а в 1900 году — криптон. Эти открытия подтвердили существование группы газов, которые не проявляют активность в химических реакциях.
В начале XX века учёные начали осознавать, что инертные газы обладают полностью заполненной внешней электронной оболочкой, что делает их химически стабильными. Это открытие стало основой для понимания их инертности. В 1913 году Нильс Бор предложил модель атома, которая объясняла, почему инертные газы не вступают в реакции: их электроны расположены в стабильных энергетических уровнях, что делает их менее склонными к взаимодействию с другими элементами.
С развитием квантовой механики в 1920-х годах учёные смогли глубже понять электронные конфигурации инертных газов. Исследования показали, что инертные газы имеют высокие энергии ионизации, что делает их трудными для возбуждения и, следовательно, для участия в химических реакциях. Эти открытия подтвердили, что инертные газы имеют уникальные свойства, отличающие их от других элементов.
В 1960-х и 1970-х годах учёные начали исследовать возможность создания соединений с инертными газами. Хотя это было сложно из-за их низкой реакционной способности, некоторые соединения, такие как ксеноновые фториды, были синтезированы. Эти эксперименты открыли новые горизонты в химии и показали, что инертные газы могут быть вовлечены в реакции при определённых условиях, хотя это и происходит крайне редко.
Таким образом, историческое развитие изучения инертных газов прошло через несколько ключевых этапов, начиная с их открытия и заканчивая современными исследованиями, которые продолжают расширять наши знания о химической природе этих уникальных элементов. Понимание их свойств и поведения стало важным вкладом в химию и физику, открыв новые возможности для научных исследований и практического применения.
Вопрос-ответ
Почему инертные газы не реагируют?
Это объясняется тем, что их внешние атомные оболочки полностью «укомплектованы» (кроме гелия) восемью электронами и являются энергетически стабильными. Эти газы называют благородными или редкими. В группу входят: гелий, неон, аргон, криптон, ксенон и радиоактивный радон.
Почему инертные газы не участвуют в химических реакциях?
В заключение следует отметить, что благородные газы не участвуют в химических реакциях, поскольку они уже обладают полной внешней электронной оболочкой и, следовательно, стабильны, не имея стремления приобретать, терять или делиться электронами.
Почему инертные газы не образуют соединения?
Инертные газы, такие как гелий, неон и аргон, не образуют соединений из-за их полной внешней электронной оболочки, что делает их химически стабильными и не склонными к реакциям с другими элементами. Поскольку они не нуждаются в обмене или делении электронов для достижения стабильности, они не образуют химические связи.
Могут ли инертные газы вступать в реакцию?
Как и у благородных газов, тенденция к инертности обусловлена тем, что валентность (внешняя электронная оболочка) всех инертных газов является целостной. Это тенденция, а не правило, поскольку все благородные газы и другие «инертные» газы могут реагировать с образованием соединений при определённых условиях.
Советы
СОВЕТ №1
Изучите свойства инертных газов, таких как гелий, неон и аргон. Понимание их электронной конфигурации поможет вам лучше осознать, почему они не склонны к химическим реакциям.
СОВЕТ №2
Обратите внимание на примеры применения инертных газов в промышленности и науке. Например, они используются в сварке и освещении, что демонстрирует их уникальные свойства и стабильность.
СОВЕТ №3
Проведите эксперименты с различными газами в домашних условиях (при соблюдении всех мер безопасности). Это поможет вам на практике увидеть, как инертные газы ведут себя по сравнению с реакционноспособными газами.